
产品货号:
RFT201
中文名称:
植物原生质体制备及转化试剂盒
英文名称:
产品规格:
40T
发货周期:
1~3天
产品价格:
询价
本试剂盒采用酶解法分离原生质体,用于原生质体的制备及转化。

酶解法分离原生质体是一个常用的技术,其原理是植物细胞壁主要由纤维素、半纤维素和果胶质组成,因而使用纤维素酶、半纤维素酶、离析酶和果胶酶能降解细胞壁成分,去除细胞壁,即可得到原生质体。许多方法可诱导原生质体融合,现在被广泛采用的融合方法是聚乙二醇(PEG)法。聚乙二醇(PEG)作为一种高分子化合物,合适的浓度能对原生质体产生瞬间冲击效应,原生质体很快发生收缩与粘连,随后用高钙高pH法进行清洗,使原生质体融合得以完成。

植物原生质体是指脱去全部细胞壁由质膜包被的具有生命活力的裸露细胞。它具有细胞生命特征和全能型,是细胞无性系变异和突变体筛选的重要来源,同时也是植物遗传工程的理想受体和遗传改良的理想材料。

| 组分 | 规格 | 保存 | |
| 溶液I-酶溶解溶液(2×) | 100mL | -20℃ | |
| 溶液II-漂洗溶液 | 200mL | ||
| 溶液III-重悬溶液 | 25mL | ||
| 组份IV-转化试剂 | 转化试剂溶解液(2×) | 3mL | |
| 转化试剂粉末 | 2g | ||
| 溶液V-培养溶液 | 25mL | ||
| BSA溶液(50mg/mL) | 5mL | ||
| 还原剂 | 1mL | RT | |
保存:-20℃,有效期1年。

- 按照每次使用5mL酶消化体系计算,本试剂盒可用于40次酶消化反应。本试剂盒每个5mL反应体系可处理0.1g左右的拟南芥叶片(约10~15叶片),操作较好的情况下每5mL体系可获得约50~70万个原生质体(不同植物不同操作会有一定的差异),可满足约25~70个样品的原生质体质粒转染操作(按照每样1~2万个细胞计算)。
- 原生质体转化时,本试剂盒可以用于相当于6孔板40个孔的样品,12孔板80个孔的样品,或24孔板160个孔的样品的转化。

剪尖吸头(剪尖后可以用酒精灯过火将吸头处理平滑)、纤维素酶R-10、离析酶R-10、平头镊子、70μm细胞过滤筛、一次性刀片、50mL离心管、1.5mL离心管、水浴锅。

一、原生质体分离
- 即用型酶溶液配制
成分 5mL配制量 10mL配制量 2×溶液I 2.5mL 5mL 纤维素酶R-10 0.075g 0.15g 离析酶R-10 0.02g 0.04g 混匀后55℃水浴10min,期间颠倒混匀2~3次,冷却至常温后加入以下成分。 - 55℃孵育可以有效灭活DNase和Protease,并促进酶溶解。
还原剂 2.5μL 5μL 50mg/mL BSA 0.1mL 0.2mL 灭菌水 定容至5mL 定容至10mL - 即用型酶溶液现用现配,不建议配制后冻存后再使用。
- 配制好的即用型酶溶液为透明棕黄色,如图所示,如果使用的纤维素酶和离析酶纯度不高,溶液为浑浊的白色,无法酶解。

- 酶解:取生长状态良好的叶片切成0.5~1mm的小条,按照0.1克叶片(拟南芥约15~20个叶片)加5mL即用型酶溶液的比例迅速将切割好的叶片小条浸泡于酶溶液中,避光,无需震荡,常温(20~25℃)酶解3小时,间歇混匀。
- 酶解时间与叶片种类,叶片生长状态有关,请根据实验需要适当调整酶解时间。3小时为拟南芥叶片推荐的酶解时间。如条件允许,可以使用微型真空泵常温避光条件下抽真空30min,以使酶溶液更好地进入细胞间隙。酶溶液变为绿色表明有原生质体已经有分离,溶液为浓绿色表明原生质体已经大量分离。拟南芥原生质体大小约为30~50μm,显微镜镜检后确定是否分离。叶片原生质体细胞显微镜下为绿色圆球状,叶绿体分散在整个细胞内,说明状态较好;如呈现不规则形状,说明原生质体破碎或即将破碎。
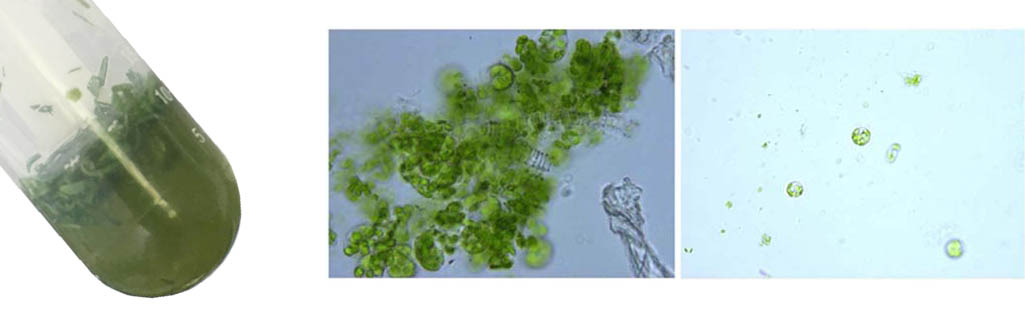
- 漂洗:酶解后加入等体积的溶液II,如使用5mL酶解体系,加入5mL溶液II,轻柔混匀。
- 过滤:用孔径70μm筛网过滤步骤3中的溶液,去除未消化的叶片,收集滤出液于50mL离心管中。
- 第一次收集:滤出液100g常温离心2分钟,尽量去除上清。
- 为了避免原生质体离心时贴在管壁,建议整个实验过程使用水平转头;离心时,可调低离心机的升速和降速。升速过快,原生质体可能离到管壁上;降速过快,可能导致管底原生质体悬起。
- 第二次收集:加入2~5mL溶液II,用剪尖的蓝吸头重悬原生质体,冰浴30分钟,原生质体在重力作用下可以沉降到离心管底部,尽量吸除上清,收集原生质体。(如果发现原生质体沉降的速度比较慢或者得率比较低,也可以考虑常温100g离心1~2min收集原生质体)。
- 重悬:小心去除上清溶液,不要触动原生质体沉淀,沉淀用剪尖的蓝吸头重悬于1mL溶液III中即为原生质体溶液。(可以用血球计数板计数,根据原生质体数量调整溶液III的加入体积,使得原生质体密度为2×105/ml或更高)。
- 制备好的原生质体可以在4℃或冰浴保存至少24h。
二、原生质体转化和培养:
- 转化溶液配制:
植物原生质体转化参考下表根据样品量配制转化溶液。
转化溶液现用现配。转化溶液需要在转化前至少1小时配制,以确保转化试剂溶解充分。转化溶液配制后尽量当天使用。配制好的转化溶液4℃保存3~5天之内仍然有较好的转化效率,但和当天配制的转化溶液相比,转化效果可能会有一定程度的下降。成分 120μL(1个样品) 1.2mL(10个样品) 5mL(约40个样品) 转化试剂粉末 48mg 480mg 2g 转化试剂溶解液(2×) 60μL 0.6mL 2.5mL 灭菌水 定容至120μL 定容至1.2mL 定容至5mL - 准备质粒:取10μL质粒DNA(10~20μg,浓度为1~2μg/μl)于1.5mL离心管中。
- 质粒大小建议为5~10kb,质粒浓度为1~2μg/μl左右;
- 原生质体转化对于质粒的纯度要求较高,尽量使用高纯度的质粒。
- 质粒大小建议为5~10kb,质粒浓度为1~2μg/μl左右;
- 质粒转化:
- 质粒管中加入100μL原生质体溶液(原生质体密度为2×105/ml,约2万个原生质体),轻柔混匀。
- 加入等体积即110μL步骤1事先准备好的转化溶液,轻弹管底,轻柔混匀,常温25℃放置5~15分钟。
- 最长可以孵育15min,但通常孵育5min时间已经足够。最佳的孵育时间对于不同的原生质体和不同的质粒需要通过实验摸索。
- 质粒管中加入100μL原生质体溶液(原生质体密度为2×105/ml,约2万个原生质体),轻柔混匀。
- 终止转化:加入2倍体积即440μL溶液II,轻柔彻底混匀,终止转化过程。
- 收集原生质体:常温100g离心1~2分钟,尽量去除上清。
- 由于转化后的溶液会非常粘稠,加入溶液II后离心1min通常可以使原生质体聚集在管底,但使用某些突变体时为减少原生质体损失,可将离心时间延长到2min。
- 原生质体漂洗:加入500μL溶液II轻轻重悬原生质体,常温100g离心1min,尽量去除残留的上清。
- 本步骤可以充分去除残留的转染试剂溶液中的组分,避免转染试剂溶液中的组分对于后续的不良影响。
- 原生质体重悬:沉淀中加入1mL溶液V,轻柔重悬。
- 原生质体培养:将离心管水平放置,23~25℃弱光培养。
- 根据实验需求确定孵育时间。RNA分析孵育2~6小时;酶活性分析和蛋白标记实验孵育2~16小时;基因编辑的效果在转染24小时后可能被检测到。

使用原生质体植物原生质体制备及转化试剂盒转染拟南芥原生质体的效果图。
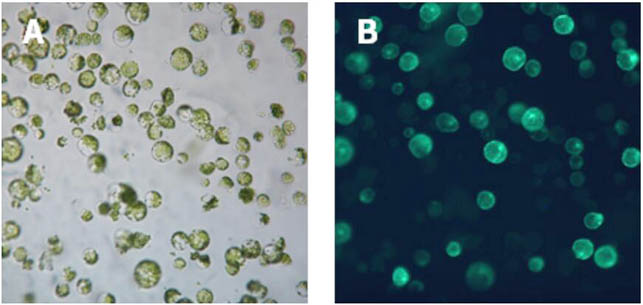
称取0.48g转化试剂于2mL离心管中,加入转化试剂溶解液后,颠倒混匀,蒸馏水定容至2mL,使转化试剂充分溶解后备用。在2mL的圆底离心管中加入10μL(20μg)EGFP质粒(植物用绿色荧光蛋白),加入100μL制备好的原生质体,轻柔混匀后加入110μL当日配制好的转化试剂溶液,轻柔混匀,常温静置5min后加入440μL溶液II终止转化,轻轻颠倒混匀,常温100g离心1min,去除上清,再加入0.5mL溶液II,轻柔重悬原生质体,常温100g离心1min后,尽量去除上清,收集原生质体。加入1mL溶液V,小心重悬原生质体后水平放置25℃培养过夜(约16h),次日于荧光显微镜下检测EGFP荧光信号。
相关搜索:植物原生质体制备及转化试剂盒,原生质体制备



